Fruto dos resultados do Mestrado Profissional desenvolvido pela técnica Thais Aragão Horoiwa, do Laboratório de Processos Químicos e Tecnologia de Partículas do IPT, as pesquisas já renderam uma patente para o Instituto e, atualmente, a formulação inicial do medicamento passa por testes pré-clínicos no Instituto de Ciências Biomédicas da Universidade de São Paulo (ICB-USP).
Acompanhe a seguir as etapas de desenvolvimento do fármaco, o que muda em caso de sucesso da produção do medicamento e por que, ainda que se trate de uma doença endêmica no Brasil, tão poucas são as iniciativas para melhorar o tratamento de suas vítimas.
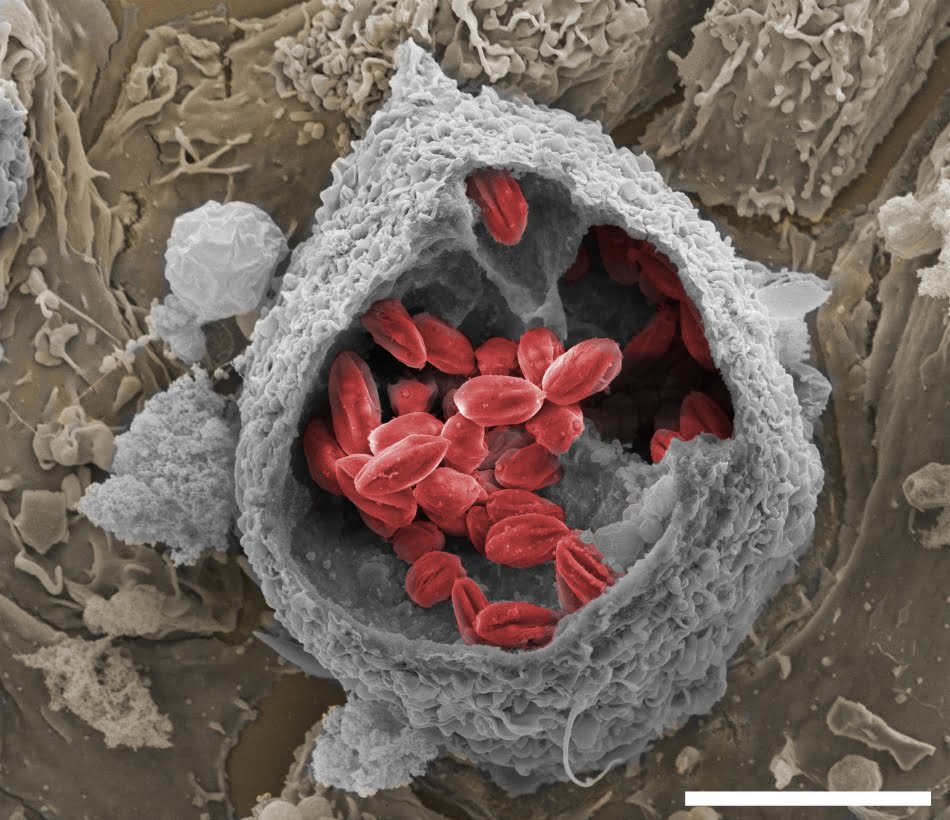
A DOENÇA – Leishmaniose é o nome utilizado para identificar um conjunto de doenças infectocontagiosas causadas por protozoários do gênero Leishmania. Comuns em humanos, mas também em animais (especialmente cães), a doença pode se manifestar de diversas formas, sendo que na mais comum – chamada tegumentar ou cutânea –, o protozoário se instala nos macrófagos (células de defesa) da epiderme e faz com que o paciente desenvolva feridas na pele e mucosas.
Atualmente, no Brasil, o tratamento da doença é oferecido pelo SUS e feito de forma injetável. Em termos simples, o paciente recebe diariamente, por um período de 20 dias, injeções com doses de 10 a 20 mg de um medicamento comercialmente conhecido por Glucantime® (antimoniato de meglumina), única droga autorizada no Brasil para tratamento da doença. A aplicação é feita diretamente no local onde o protozoário está instalado – ou seja, na ferida. “O tratamento é extremamente doloroso e depende da internação do paciente para a aplicação do medicamento e controle dos efeitos colaterais, que são intensos. Dependendo da dosagem aplicada, a pessoa pode ir à óbito, porque a substância injetada é tóxica a órgãos vitais como rins, fígado e coração”, explica Thais.
Na prática isso significa três coisas. Primeiro: o tratamento é oneroso ao sistema de saúde, que tem uma série de gastos ao manter o paciente internado por muitos dias, tanto relacionados à mão de obra quanto a recursos. Segundo: muitos pacientes abandonam o tratamento na metade, o que pode gerar complicações – por exemplo, o desenvolvimento da doença em suas formas mais graves, como a leishmaniose visceral, que ataca os órgãos internos do corpo – e mantém o indivíduo como hospedeiro do parasita, que é transmitido por um mosquito. E terceiro: uma doença que em princípio não leva à morte pode ser complicada pelo uso do seu próprio remédio.
A TECNOLOGIA – A pesquisa desenvolvida por Thais visa a criação de um medicamento para uso tópico (pomada ou creme) que possa ser aplicado pelo próprio paciente e dispense a internação em hospitais, uma alternativa também menos dolorosa que a atual. A tecnologia é baseada no uso de nanocarreadores poliméricos coloidais, sistemas capazes de levar medicamentos diretamente até o local do organismo onde devem agir, construídos em uma escala de tamanho de 1 nanômetro – ou 1 bilionésimo de metro.

Thais conta que a tecnologia funciona como uma espécie de “cavalo de Tróia”. Isso porque o protozoário, alojado na epiderme, apresenta receptores em sua parede celular que reconhecem moléculas de glicoconjugados produzidas a partir de açúcares recebidos pelas células. “O uso da maltodextrina faz com que o medicamento atinja preferencialmente as células infectadas, porque o colocamos dentro de uma molécula que o parasita necessita em seu metabolismo. Em tese, o açúcar iria preferencialmente para as células que o estão demandando mais”, explica a técnica.
Outra inovação do projeto está no fato de ela basear-se em uma dispersão inversa em que nanoestruturas hidrofílicas estão envoltas em um silicone biodegradável, já utilizado pela indústria farmacêutica em outros medicamentos. O silicone é biocompatível e um facilitador da interação do medicamento com a pele porque reduz a tensão superficial, melhorando a espalhabilidade e a permeabilidade dos componentes da formulação através das células epiteliais e também promovendo a entrega do fármaco em camadas mais profundas da pele.
A formulação inicial passou por dois testes principais no IPT: o de liberação e o de permeação cutânea. O primeiro comparou o perfil de liberação do fármaco encapsulado na pele com o fármaco livre, utilizado nas doses injetáveis do tratamento atual. Resultado: ao passo que o fármaco livre é liberado de uma só vez, tendo uma atuação por tempo limitado no organismo, o nanocarreador promove uma liberação sustentada, que cresce ao longo do tempo. “Isso pode indicar que, no caso do uso de uma pomada, por exemplo, o paciente poderia fazer um curativo e deixar o medicamento agir na ferida por um tempo mais prolongado, sem a necessidade de reaplicação recorrente da dose”, afirma a técnica.
O desafio no segundo teste era entender se o fármaco encapsulado e de forma tópica conseguiria passar pelo estrato córneo da pele, camada que recobre a epiderme (onde está o protozoário). Para tal, a formulação foi aplicada em uma membrana animal semelhante à pele humana. “O fármaco encapsulado não apenas penetra nas camadas mais profundas da pele, como se mantém mais concentrado do que o medicamento livre. Apesar de uma parte considerável ficar retida no estrato córneo, também consideramos o fato de que, quando a doença está instalada, observam-se feridas onde essa camada superior não está mais presente. Como o medicamento seria aplicado diretamente na epiderme, espera-se que a eficiência seja ainda maior”, avalia ela.
Segundo Thais, os ensaios de permeação cutânea também mostraram que o fármaco não chegaria à corrente sanguínea mesmo estando encapsulado em uma estrutura nanométrica, ficando retido preferencialmente nas camadas da pele. Em termos práticos, isso significa que a chance de haver efeitos colaterais é muito menor.
O CAMINHO – A formulação criada no IPT passa, agora, por testes preliminares no ICB-USP, cujo principal objetivo é avaliar a eficiência dos nanocarreadores contra o protozoário em animais. Embora o antimoniato de meglumina tenha ação efetiva comprovada no tratamento, é preciso entender como o sistema de nanocarreamento elaborado no IPT traz ganho em comparação com a terapêutica atual.
“Nessa fase, procuramos observar o efeito tóxico do composto diretamente contra o parasita in vitro”, explica Mauro Javier Cortez Veliz, pesquisador do Departamento de Parasitologia do ICB. “Inicialmente estamos trabalhando com a Leishmania amazonensis, causadora de dois tipos de leishmaniose cutânea, mas a ideia é realizar testes em diferentes espécies e entender a eficácia da droga em combatê-las”.
Testes de citotoxicidade, ou seja, que garantam que o medicamento não afetará de forma agressiva também as células saudáveis, são o último passo para comprovar a eficácia do fármaco. “Em caso de sucesso nos testes, a metodologia principal será a realização de testes em modelo animal, em que será possível comprovar efetivamente a eficácia do tratamento tópico através dos nanocarreadores coloidais. Analisaremos o curso de infecção e verificaremos a quantidade de parasita (carga parasitária) na lesão do animal após o tratamento”, explica Veliz.
A partir daí, a evolução dependeria, sobretudo, de uma parceria com alguma indústria farmacêutica – etapa em que seria possível melhorar a formulação inicial do medicamento, estudar a viabilidade financeira de sua produção e realizar testes finais em animais e humanos para a disponibilização do fármaco no mercado.
O “X” DA QUESTÃO – Embora a tecnologia seja promissora e cerca de 1 milhão de novos casos de leishmaniose cutânea sejam computados por ano no mundo, ainda assim o medicamento deve encontrar entraves para se tornar realidade no Brasil.
Isso porque a enfermidade faz parte do rol das chamadas doenças negligenciadas: tropicais, endêmicas, e concentradas em populações de baixa renda de países subdesenvolvidos ou em desenvolvimento da Ásia, África e América Latina. Comuns em locais com maior dificuldade de acesso ao saneamento básico – onde o mosquito transmissor tem mais chances de se proliferar – e, portanto, em populações marginalizadas, de menor poder aquisitivo, são poucos os recursos destinados a pesquisas, e menor ainda o interesse das indústrias farmacêuticas em se arriscar a investir em medicamentos que podem não dar retornos financeiros satisfatórios.

Presente no 6º Congresso Mundial em Leishmaniose realizado na Espanha em 2017, Veliz aponta ainda outros problemas relacionados à doença na atualidade. Em locais em conflito bélico, como Sudão e Síria, a precariedade das condições sanitárias tem causado um aumento dos casos de leishmaniose – e a situação descamba para um aumento de registros também em regiões não endêmicas, que recebem refugiados do conflito. No Brasil, o desmatamento e a urbanização também têm levado o foco da doença para os centros urbanos, uma vez que o número de hospedeiros aumenta nesses locais.
“Usamos medicamentos feitos há mais de 70 anos. O desenvolvimento de novas estratégias quimioterápicas, eficazes, menos tóxicas e de baixo custo, são prioridade em um cenário mundial de mais de 350 milhões de pessoas expostas ao risco de contrair a leishmaniose”, opina o pesquisador.
Se apenas melhorar as condições do doente ou o cenário da doença não bastam para a indústria, Thais aponta que o maior trunfo para o desenvolvimento do novo medicamento pode ser a própria forma de tratamento atual. Isso porque a longa internação, a disponibilidade de vagas nos postos de saúde e os recursos dispendidos para curar a leishmaniose, tanto com mão de obra quanto com medicamentos, podem tornar o tratamento tópico mais vantajoso financeiramente.
“Pensando em termos de processo, é provável que seja mais caro para a indústria farmacêutica produzir o novo medicamento baseado em nanotecnologia. Porém, em termos de políticas públicas, os gastos com a doença seriam drasticamente reduzidos. Programas governamentais que priorizem o desenvolvimento de alternativas terapêuticas para o tratamento de doenças negligenciadas podem incentivar a indústria a produzi-lo”, opina Thais.
Por último, a técnica chama atenção ainda para o fato de que se trata de uma doença complicada para a sociabilidade do paciente. “É importante lembrar que as feridas surgem inicialmente no local da picada do mosquito, geralmente áreas expostas do corpo, como membros e rosto. Como são lesões de aparência que remetem a doenças transmissíveis, mesmo não o sendo, é comum as pessoas sofrerem preconceito ou enfrentarem constrangimentos em espaços públicos. A leishmaniose não é somente um problema grave de saúde pública. Por tudo que envolve, é um problema sócio-econômico”, finaliza.